Содержание полезных бактерий в иммунных клетках
Согласно новому исследованию, проведенному исследователями Weill Cornell Medicine и NewYork-Presbyterian, подмножество иммунных клеток, называемое врожденными лимфоидными клетками (ILC3s), защищает от колоректального рака, отчасти помогая поддерживать здоровый диалог между иммунной системой и кишечными микробами. Открытие открывает дверь к новым стратегиям лечения этого типа рака.

Художественная визуализация опухоли, растущей в толстой кишке, приводящей к локальным изменениям резидентной микробиоты. Предоставлено: Сара Филд Зонненберг.
Исследователи, опубликовавшие свои результаты в журнале Cell , показали, что ILC3 имеют тенденцию резко сокращаться и функционально изменяться у людей с колоректальным раком. Кроме того, они демонстрируют, что экспериментальное нарушение функций ILC3 у мышей приводит к агрессивному раку толстой кишки и значительно снижает эффективность иммунотерапии рака.
Что такое колоректальный рак?
Колоректальный рак — это заболевание, при котором клетки толстой или прямой кишки бесконтрольно разрастаются. Иногда его называют раком толстой кишки. Ободочная кишка — это толстая или толстая кишка. Прямая кишка — это проход, соединяющий толстую кишку с анусом.
Колоректальный рак является четвертым по распространенности раком в Соединенных Штатах: ежегодно регистрируется около 150 000 новых случаев и около 50 000 случаев смерти. Хотя раннее выявление этих видов рака или предраковых полипов с помощью скрининговых колоноскопий очень эффективно, лечение запущенных колоректальных опухолей остается серьезной проблемой с ограниченными терапевтическими возможностями. Онкологов особенно беспокоит относительная устойчивость этих опухолей к иммунотерапии — методам лечения, которые хорошо работают против некоторых других видов рака, повышая способность иммунной системы атаковать злокачественные клетки.
«Эти результаты предлагают новые возможности для клинического подхода к колоректальному раку, а также помогают объяснить, почему этот тип рака часто не реагирует на иммунотерапию», — сказал старший автор доктор Грегори Зонненберг, доцент кафедры микробиологии и иммунологии в медицине. Отделение гастроэнтерологии и гепатологии и член Института исследований воспалительного заболевания кишечника Джилл Робертс в Weill Cornell Medicine.
Одним из факторов, влияющих на устойчивость к иммунотерапии, может быть микробиом кишечника, популяция бактерий и других видов микробов, которые обитают в кишечнике и обычно помогают пищеварению, поддерживают различные метаболические функции и играют роль в регулировании иммунной системы. Колоректальный рак связан с хроническим воспалением кишечника и серьезным нарушением нормального микробиома. Кроме того, недавние исследования показывают, что микробиомы пациентов играют ключевую роль в контроле результатов иммунотерапии рака и могут объяснить, почему некоторые виды рака у некоторых пациентов хорошо или не реагируют на лечение.
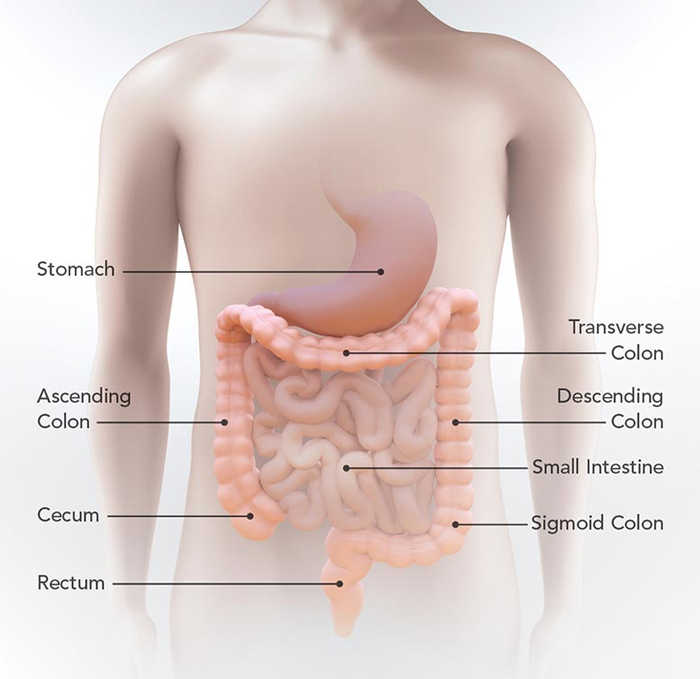
На этой диаграмме показано расположение желудка, тонкой кишки, слепой кишки, восходящей ободочной кишки, поперечной ободочной кишки, нисходящей ободочной кишки, сигмовидной кишки и прямой кишки. Предоставлено: CDC.
В новом исследовании доктор Зонненберг и его коллеги, включая ведущего автора доктора Джереми Гока, научного сотрудника лаборатории доктора Зонненберга, изучили роль ILC3, которые находятся в кишечнике и, как известно, помогают опосредовать взаимосвязь между иммунными клетками. системные и кишечные микробы.
Врожденные лимфоидные клетки группы 3 обычно играют ключевую роль в поддержании здорового диалога между микробиомом и иммунной средой в нижнем отделе кишечника.
В тесном сотрудничестве с доктором Маниш Шах, семейным профессором онкологии желудочно-кишечного тракта Бартлеттов, директором программы онкологии желудочно-кишечного тракта в отделении гематологии и медицинской онкологии и членом исследовательской группы онкологического центра Сандры и Эдварда Мейера в Weill Cornell Medicine. проанализировали колоректальные опухоли и предраковые полипы у людей и мышей. Они обнаружили, что ILC3 из раковых тканей были относительно истощены по сравнению со здоровыми тканями и в дальнейшем фундаментально изменились в своих функциях.
«Это захватывающее открытие, которое может иметь широкое значение для нашего понимания путей, которые контролируют патогенез, прогрессирование и терапевтическую реакцию на злокачественные новообразования желудочно-кишечного тракта», — сказал соавтор исследования доктор Шах, который также является руководителем службы онкологии солидных опухолей. и содиректор Центра усовершенствованного лечения пищеварительной системы в Пресвитерианском медицинском центре Нью-Йорка / Вейл Корнелл.
- Помимо этой потери нормальной активности ILC3 в кишечнике, авторы также заметили, что способность ILC3 регулировать специфический субнабор иммунных клеток, называемый Т-клетками, была значительно нарушена.
- Это нарушение диалога между ILC3 и Т-клетками привело к усилению воспаления в кишечнике, которое впоследствии изменяет микробиом кишечника.
- Эти изменения кишечных микробов, в свою очередь, вызывают снижение уровня Т-клеток, которые хорошо борются с опухолями.
Эти коллективные результаты имеют серьезные последствия для развития опухоли, как показали исследователи. У мышей, у которых развивается рак толстой кишки, блокирование передачи сигналов ILC3 приводило к росту аномально инвазивных и более агрессивных опухолей с плохим исходом. И когда опухоли толстой кишки были имплантированы мышам с заблокированной передачей сигналов ILC3, опухоли были относительно невосприимчивы к иммунотерапии рака, называемой блокадой контрольных точек анти-PD-1, тогда как опухоли того же типа, имплантированные мышам с нормальной передачей сигналов ILC3, хорошо реагировали на терапия.
Наконец, в биопсии колоректальных тканей пациентов с воспалительным заболеванием кишечника (ВЗК) исследователи обнаружили аномалии, связанные с ILC3, аналогичные таковым у пациентов с колоректальным раком. Трансплантация микробов от пациентов с ВЗК мышам вызвала резистентность к терапии, тогда как мыши, которым трансплантировали микробы от здоровых доноров-людей, по-прежнему хорошо отвечали на блокаду контрольных точек анти-PD-1.
Вклад микробиома в развитие рака
«Лучшее понимание вклада микробиома в развитие рака и отзывчивость к лечению может революционизировать стратегии ведения пациентов. Это исследование проливает свет на механизм резистентности к терапии, вызванный нарушением регуляции микробиома, который до сих пор недооценивался», — сказал доктор Гок. «Это предполагает, например, что однажды мы сможем взять образцы микробиоты кишечника, чтобы предсказать прогрессирование опухоли и реакцию на иммунотерапию — и даже использовать здоровую микробиоту для улучшения реакции на лечение».
В настоящее время исследователи работают над определением наиболее полезных в этом отношении видов кишечных бактерий. Это исследование частично поддерживается новым механизмом финансирования от Института исследований рака, который был предоставлен доктору Зонненбергу в 2019 году, в год открытия программы.
Исследования в лаборатории Зонненберга также поддерживаются Национальными институтами здравоохранения (R01AI143842, R01AI123368, R01AI145989, U01AI095608, R21CA249274 и R01AI162936), исследователями патогенеза инфекционных заболеваний, премия Фонда исследований рака и рака имени Берроуза. Институт (CRI), Грант исследователя CLIP, Премия CRI Lloyd J. Old STAR, Инициатива по совместным исследованиям онкологического центра Мейера, Фонд семьи Далтонов и Линда и Гленн Гринберг. Джереми Гока поддерживает стипендии Фонда Крона и Колита (519428) и Фонда Филиппа. Грег Зонненберг — CRI Lloyd J. Old STAR. Грегори Ф. Зонненберг ранее входил в состав научно-консультативного совета и в течение последних 12 месяцев владел акциями Celsius Therapeutics Inc.
Метки: Иммунология
- Ученые обратили вспять выпадение волос
- Обнаружены скрытые генетические причины врожденных пороков сердца
- Обнаружено мощное оружие в борьбе с болезнью Альцгеймера
- Раскрыты секреты 37 ключевых генов, связанных с репродуктивным здоровьем человека
- Могут ли кишечные бактерии замедлить старение?
- Открыта загадочная болезнь, имитирующая психическое расстройство
- Ожирение у матерей удваивает риск аутизма у детей
- Критические белки рака и места их взаимодействия
- Причины алкоголизма и наркомании
- Почему следует есть больше скумбрии и меньше лосося?





